Atom ve Molekül Yapısı
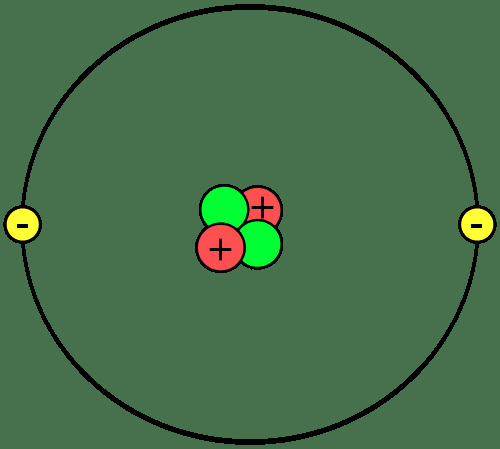
Maddenin yapı taşları, moleküller veya bileşikler oluşturmak için bir araya gelen atomlardır. Bir atomun parçalarını, iyonların ve izotopların ne olduğunu ve atomların nasıl birleştiğini bilmek önemlidir.
Bir Atomun Parçaları
Atomlar üç bileşenden oluşur:
- protonlar - pozitif elektrik yükü
- nötronlar - elektrik yükü yok
- elektronlar - negatif elektrik yükü
Protonlar ve nötronlar, her atomun çekirdeğini veya merkezini oluşturur. Elektronlar çekirdeğin yörüngesinde. Bu nedenle, her atomun çekirdeği net bir pozitif yüke sahipken, atomun dış kısmı net bir negatif yüke sahiptir. Kimyasal reaksiyonlarda, atomlar elektronları kaybeder, kazanır veya paylaşır. Çekirdek, sıradan kimyasal reaksiyonlara katılmaz, ancak nükleer bozulma ve nükleer reaksiyonlar atom çekirdeğinde değişikliklere neden olabilir.
Atomlar, İyonlar ve İzotoplar
Bir atomdaki proton sayısı, onun hangi element olduğunu belirler. Her öğenin bir veya iki harfli
sembol kimyasal formüllerde ve reaksiyonlarda tanımlamak için kullanılır. Helyumun sembolü O'dur. İki protonlu bir atom, kaç nötron veya elektrona sahip olduğuna bakılmaksızın bir helyum atomudur. Bir atom aynı sayıda proton, nötron ve elektrona sahip olabilir veya nötron ve / veya elektron sayısı proton sayısından farklı olabilir.Net pozitif veya negatif elektrik yükü taşıyan atomlar iyonlar. Örneğin, bir helyum atomu iki elektron kaybederse, net bir +2 yüküne sahip olacak ve2+.
Bir atomdaki nötron sayısının değiştirilmesi, izotop bir elementin. Atomlar izotoplarını tanımlamak için nükleer sembollerle yazılabilir, burada nükleon sayısı (protonlar artı nötronlar) bir eleman sembolünün üstünde ve solunda, aşağıda listelenen protonların sayısı ve solda listelenir. sembolü. Örneğin, üç hidrojen izotopu:
11H, 21H, 31'H
Proton sayısının bir elementin atomu için asla değişmediğini bildiğiniz için, izotoplar element sembolü ve nükleon sayısı kullanılarak daha yaygın olarak yazılır. Örneğin, üç hidrojen izotopu için H-1, H-2 ve H-3 veya iki yaygın uranyum izotopu için U-236 ve U-238 yazabilirsiniz.
Atom Numarası ve Atom Ağırlığı
atomik numara bir atomun elementini ve proton sayısını tanımlar. atom ağırlığı proton sayısı artı bir elementteki nötron sayısıdır (çünkü elektron kütlesi, esas olarak sayılmayan protonların ve nötronlarınkine kıyasla çok azdır). Atom ağırlığı bazen atom kütlesi veya atom kütlesi numarası olarak adlandırılır. Helyumun atom numarası 2'dir. Helyumun atom ağırlığı 4'tür. Periyodik tablodaki bir elementin atom kütlesinin bir tam sayı olmadığını unutmayın. Örneğin, helyumun atomik kütlesi 4 yerine 4.003 olarak verilir. Bunun nedeni periyodik tablonun bir elementin izotoplarının doğal bolluğunu yansıtmasıdır. Kimya hesaplamalarında, bir elementin bir örneğinin o elementin doğal izotop aralığını yansıttığını varsayarak periyodik tabloda verilen atomik kütleyi kullanırsınız.
Moleküller
Atomlar birbirleriyle etkileşir, genellikle birbirleriyle kimyasal bağlar oluştururlar. İki veya daha fazla atom birbirine bağlandığında, bir molekül oluştururlar. Bir molekül H gibi basit olabilir2veya C gibi daha karmaşık6'H12Ö6. Abonelikler, bir moleküldeki her bir atom tipinin sayısını gösterir. İlk örnek, iki hidrojen atomundan oluşan bir molekülü tarif eder. İkinci örnek, 6 karbon atomu, 12 hidrojen atomu ve 6 oksijen atomundan oluşan bir molekülü tarif eder. Atomları herhangi bir sırada yazabilmenize rağmen, kural önce bir molekülün pozitif yüklü geçmişini, ardından molekülün negatif yüklü kısmını yazmaktır. Bu nedenle sodyum klorür, ClNa'ya değil NaCl'ye yazılır.
Periyodik Tablo Notları ve Gözden Geçirme
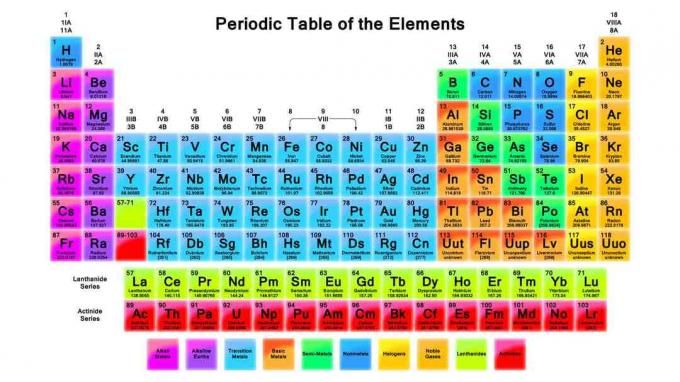
Periyodik tablo kimyada önemli bir araçtır. Bu notlar periyodik tabloyu, nasıl düzenlendiğini ve periyodik tablo trendlerini gözden geçirir.
Periyodik Tablonun İcadı ve Organizasyonu
1869'da, Dmitri Mendeleev kimyasal elementleri elementleri dışında bugün kullandığımız gibi periyodik bir tablo halinde düzenledi artan atom ağırlığına göre sıralanırken, modern masa atomik artışla düzenlenir numara. Elementlerin düzenlenme şekli, element özelliklerindeki eğilimleri görmeyi ve elementlerin kimyasal reaksiyonlardaki davranışını tahmin etmeyi mümkün kılar.
Satırlar (sola sağa hareket eden) çağrılır dönemleri. Bir periyottaki elementler, kesilmemiş bir elektron için aynı en yüksek enerji seviyesini paylaşır. Atom boyutu arttıkça, enerji seviyesi başına daha fazla alt seviye vardır, bu nedenle tablonun ilerleyen dönemlerinde daha fazla element vardır.
Sütunlar (yukarıdan aşağıya hareket ederek) öğenin temelini oluşturur gruplar. Gruplardaki elemanlar, bir gruptaki elemanlara birkaç ortak özellik veren aynı sayıda değerlik elektronunu veya dış elektron kabuğu düzenlemesini paylaşır. Element gruplarına örnek olarak alkali metaller ve asil gazlar gösterilebilir.
Periyodik Tablo Eğilimleri veya Periyodiklik
Periyodik tablonun organizasyonu, bir bakışta elemanların özelliklerindeki eğilimleri görmeyi mümkün kılar. Önemli eğilimler bir atom yarıçapı, iyonlaşma enerjisi, elektronegatiflik ve elektron ilgisi ile ilgilidir.
-
Atom Yarıçapı
Atom yarıçapı bir atomun boyutunu yansıtır. Atom yarıçapı soldan sağa hareket etmeyi azaltır bir süre boyunca ve yukarıdan aşağıya doğru hareket etmeyi artırır bir öğe grubu aşağı. Atomların daha fazla elektron kazandıkça daha da büyüyeceğini düşünebilirsiniz, ancak artan proton sayısı kabukları çekirdeğe çeker. Bir grubu aşağı doğru hareket ettirerek, yeni enerji kabuklarında elektronlar çekirdekten daha fazla bulunur, böylece atomun toplam boyutu artar. -
İyonlaşma enerjisi
İyonizasyon enerjisi, gaz durumundaki bir iyon veya atomdan bir elektronun uzaklaştırılması için gereken enerji miktarıdır. İyonlaşma enerjisi soldan sağa hareket etmeyi artırır bir süre boyunca ve yukarıdan aşağıya hareket etmeyi azaltır bir grup aşağı. -
Elektronegativite
Elektronegatiflik, bir atomun kimyasal bir bağı ne kadar kolay oluşturduğunun bir ölçüsüdür. Elektronegatiflik ne kadar yüksek olursa, bir elektronun bağlanma cazibesi o kadar yüksek olur. Elektronegativite eleman grubunun aşağı inmesini azaltır. Periyodik tablonun sol tarafındaki elemanlar elektropozitif olma veya bir elektron bağışlama olasılığından daha fazlasını kabul etme eğilimindedir. -
Elektron ilgisi
Elektron ilgisi, bir atomun bir elektronu ne kadar kolay kabul edeceğini yansıtır. Elektron ilgisi eleman grubuna göre değişir. Soy gazların elektron kabukları sıfıra yakındır, çünkü elektron kabuklarını doldururlar. Halojenler yüksek elektron afinitelerine sahiptir, çünkü bir elektron ilavesi bir atoma tamamen dolu bir elektron kabuğu verir.
Kimyasal Bağlar ve Bağlar

Kimyasal bağlar atomların ve elektronların aşağıdaki özelliklerini göz önünde bulundurursanız kolayca anlaşılabilir:
- Atomlar en kararlı konfigürasyonu arar.
- Octet Kuralı, dış yörüngesinde 8 elektronlu atomların en kararlı olacağını belirtir.
- Atomlar diğer atomların elektronlarını paylaşabilir, verebilir veya alabilir. Bunlar kimyasal bağların formlarıdır.
- İç elektronlar değil, atomların değerlik elektronları arasında bağlar oluşur.
Kimyasal Bağ Türleri
İki ana kimyasal bağ türü iyonik ve kovalent bağlardır, ancak çeşitli bağlanma biçimlerinin farkında olmalısınız:
-
İyonik bağlar
İyonik bağlar Bir atom başka bir atomdan bir elektron aldığında oluşur. Örnek: NaCl, sodyumun değerlik elektronunu klorine bağışladığı bir iyonik bağ tarafından oluşturulur. Klor bir halojendir. Tüm halojenler 7 değerlik elektronuna sahiptir ve kararlı bir sekizli elde etmek için bir tane daha gerekir. Sodyum bir alkali metaldir. Tüm alkali metaller, bir bağ oluşturmak için kolayca bağışladıkları 1 değerlik elektronuna sahiptir. -
Kovalent bağlar
Kovalent bağlar atomlar elektronları paylaştığında oluşur. Gerçekten, ana fark, iyonik bağlardaki elektronların bir atomla daha yakından ilişkili olmasıdır veya kovalent bir bağdaki elektronların, bir çekirdeğin diğer. Elektron bir atomla diğerinden daha yakından ilişkiliyse, kutupsal kovalent bağ oluşabilir. Örnek: Hidrojen ve sudaki oksijen arasında kovalent bağlar, H2Ö. -
Metalik Bağ
İki atom metal olduğunda, metalik bir bağ oluşur. Bir metalin farkı, elektronların bir bileşikteki sadece iki atom değil, herhangi bir metal atomu olabilmesidir. Örnek: Metalik bağlar, altın veya alüminyum gibi saf elementsel metallerin veya pirinç veya bronz gibi alaşımların numunelerinde görülür.
Bir bağın iyonik veya kovalent olup olmadığını nasıl anlayabileceğinizi merak ediyor olabilirsiniz. Elementlerin periyodik tablodaki veya element tablosundaki yerleşimlerine bakabilirsiniz elektronegatiflikleri oluşacak tahvil türünü tahmin etmek. Elektronegatiflik değerleri birbirinden çok farklıysa, bir iyonik bağ oluşacaktır. Genellikle katyon bir metaldir ve anyon ametaldir. Elemanların her ikisi de metal ise, metalik bir bağ oluşmasını bekleyin. Elektronegatiflik değerleri benzerse, kovalent bir bağ oluşmasını bekleyin. İki metal olmayanlar arasındaki bağlar kovalent bağlardır. Polar kovalent bağlar, elektronegatiflik değerleri arasında ara farkları olan elemanlar arasında oluşur.
Bileşikler Nasıl Adlandırılır - Kimya Nomenklatürü
Kimyagerlerin ve diğer bilim adamlarının birbirleriyle iletişim kurmaları için, Uluslararası Saf ve Uygulamalı Kimya Birliği veya IUPAC tarafından bir isimlendirme veya adlandırma sistemi üzerinde anlaşmaya varıldı. Ortak isimleri (örneğin, tuz, şeker ve kabartma tozu) adı verilen kimyasalları duyacaksınız, ancak laboratuvarda sistematik isimler (örn. Sodyum klorür, sükroz ve sodyum bikarbonat) kullanacaksınız. İşte isimlendirme ile ilgili bazı önemli noktaların gözden geçirilmesi.
İkili Bileşikleri Adlandırma
Bileşikler sadece iki elementten (ikili bileşikler) veya ikiden fazla elementten oluşabilir. İkili bileşikler adlandırılırken belirli kurallar geçerlidir:
- Elemanlardan biri metal ise, önce isimlendirilir.
- Bazı metaller birden fazla pozitif iyon oluşturabilir. İyon üzerindeki yükü Romen rakamları kullanarak belirtmek yaygındır. Örneğin, FeCl2 demir (II) klorürdür.
- İkinci eleman ametal değilse, bileşiğin adı metal adı, ardından ametal adının bir kökü (kısaltma) ve ardından "ide" olur. Örneğin, NaCl sodyum klorür olarak adlandırılır.
- İki ametal içermeyen bileşikler için, daha elektropozitif element ilk olarak adlandırılır. İkinci elementin gövdesi "ide" ile adlandırılır. Bir örnek hidrojen klorür olan HCl'dir.
İyonik Bileşiklerin İsimlendirilmesi
İkili bileşiklerin adlandırılması kurallarına ek olarak, iyonik bileşikler için ek adlandırma kuralları vardır:
- Bazı çok atomlu anyonlar oksijen içerir. Bir element iki oksiyanyon oluşturuyorsa, daha az oksijene sahip olan -ite içinde biterken, daha fazla oksijene sahip olan -ate içinde biter. Örneğin:
HAYIR2- nitrit
HAYIR3- nitrat